von Britta Pawlak - 08.04.2007
Wie entstand eigentlich die Wissenschaft der Chemie und mit was beschäftigt sie sich? Das war Thema der ersten Kinderuni-Vorlesung in diesem Semester. Wusstest du, dass manche Stoffe, die wir im normalen Alltag zum Backen benutzen oder einfach nur einatmen, unter gewissen Umständen explosive Reaktionen hervorrufen können? Wie ist ein Atom aufgebaut und was sind die verschiedenen Aggregatzustände der Stoffe? Wir zeigen dir spannende Versuche, die du selbst ausprobieren kannst.

Die Chemie eine bedeutende Naturwissenschaft, die sich mit vielen Materialien aus dem Leben beschäftigt. Sie wird definiert als "die Lehre von den Stoffen, deren Eigenschaften, Aufbau und Veränderungen." Die Chemie beschäftigt sich also hauptsächlich mit chemischen Eigenschaften und Reaktionen von Stoffen. Der Unterschied zwischen den Naturwissenschaften von Chemie und Physik liegt hauptsächlich darin, dass in der Physik unter anderem zwar ebenfalls Stoffe geschmolzen und verändert werden - in der Physik bleibt die Grundsubstanz jedoch immer dieselbe. Die wissenschaftliche Chemie entstand einst aus der mittelalterlichen Alchemie.
Alchemisten waren Beobachter und experimentierten mit verschiedenen Stoffen. Zwar unternahmen die Alchemisten alle möglichen Versuche mit vielen Arten von Stoffen, diese waren aber oft nur wenig wissenschaftlich. In diese Künste vermischten sich philosophische Gedankengänge und mystische Elemente. So glaubten die Alchemisten, chemische Stoffe könnten mit der passenden Formel einfach ineinander umgewandelt werden. Viele beschäftigten sich vor allem mit der Suche nach einem Mittel, mit dem man Blei in Gold umwandeln könne - dem so genannten "Stein der Weisen". Andere waren auf der Suche nach einem geheimen Zaubertrunk, der alle Krankheiten heilen oder sogar zur Unsterblichkeit verhelfen könne.
Traum von der Entdeckung des "Steins der Weisen"

1669 entdeckte Hennig Brand, ein deutscher Apotheker und Alchemist, auf der Suche nach dem "Stein der Weisen" das chemische Element Phosphor, indem er Urin destillierte und den Rückstand glühte. Der Alchemist und Chemiker Johann Friedrich Böttger entdeckte um 1717 sogar das europäische Pendant des chinesischen Porzellans, doch der "Stein der Weisen" blieb ein Wunschtraum.
Die Chemie, die daraus im 17. und 18. Jahrhundert entstand, geht dagegen rein wissenschaftlich vor. Viele Ereignisse, die früher als mystisch und übernatürlich galten, sind heute - dank der Chemie - einfach erklärbar. Allein in den letzten Jahrzehnten haben chemische Forscher bahnbrechende Entdeckungen gemacht. Die Wissenschaft der Chemie hat eine große Bedeutung und findet in vielen Bereichen Anwendung, wie zum Beispiel in der Herstellung von Arzneimitteln, von Computern oder Autos - und bei unzähligen Gebrauchsgegenständen aus unserem Alltag.
Die industrielle Anwendung der Chemie führte aber auch zu immer größeren Umweltschäden, die etwa ab 1970 zum Entstehen einer Umweltbewegung führte. In den falschen Händen kann die Chemie natürlich auch viel Unheil anrichten. So kann man mit diesen wissenschaftlichen Kenntnissen Sprengmittel oder gefährliche Gase herstellen.
Atome und ihre Modelle

Schon Anfang des 19. Jahrhunderts gab es erste Modelle für Atome, die als "kleinste, chemisch nicht weiter teilbare Stoffe" definiert wurden. Atome bestehen aus einem Kern und einer Hülle. Im Atomkern, der die größte Masse eines Atoms ausmacht, befinden sich Protonen, die positiv geladen sind, und Neutronen ohne elektrische Ladung. Die Atomhülle besteht aus negativ geladenen Elektronen. Ein Atom ist "neutral", da die Anzahl der Protonen und Elektronen übereinstimmt.
Die so genannte "Kernladungszahl" gibt die Anzahl der Protonen (und somit auch die der Elektronen) eines Atoms an. Atome mit der gleichen Protonenanzahl gehören demselben chemischen Element an. Diese wird auch Ordnungszahl genannt, da nach ihr die Elemente im Periodensystem geordnet sind. Wasserstoff zum Beispiel (chemische Abkürzung H) ist das erste Element dieses Systems, da es eine Kernladungszahl von 1 hat. Die Struktur der Atomhülle ist ausschlaggebend für die chemischen Eigenschaften eines Elements.
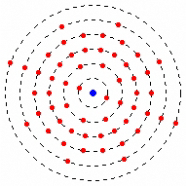
Im Schalenmodell - einer Erweiterung des Atommodells von Niels Bohr aus dem Jahre 1913 - bewegen sich die Elektronen in verschiedenen Bahnen um den Kern. Je weiter sie vom Kern entfernt sind, desto leichter können sie - zum Beispiel durch Energieeinwirkung wie Erhitzung - auf eine äußere Schale springen oder sich mit anderen Stoffen verbinden. Für die chemische Eigenschaft eines Elements sind hierbei also die Elektronen auf der äußersten Schale verantwortlich. Lösen sich negativ geladene Elektronen aus der Atomhülle eines Stoffes, ist das Teilchen positiv geladen. Nimmt ein Atom ein Elektron auf, so ist es anschließend negativ geladen. Elektrisch geladene Teilchen nennt man Ionen.
Ein Molekül ist eine chemische Verbindung, bei der sich mehrere Atome zusammengeschlossen haben. Wasser zum Beispiel besteht aus H20-Molekülen. Ein Wassermolekül ist also eine Verbindung aus den Elementen Sauerstoff (O) und Wasserstoff (H). Dabei binden sich immer zwei Wasserstoff-Atome mit einem Sauerstoff-Atom.
Fest, flüssig, gasförmig: die Aggregatzustände der Stoffe
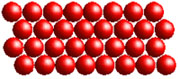
Einzelne Stoffe können in verschiedenen so genannten "Aggregatzuständen" vorliegen: fest, gasförmig und flüssig. Bei festen Stoffen sind die Teilchen dicht beieinander angeordnet, im flüssigen Zustand bewegen sie sich dagegen schneller und die Zwischenräume sind größer. Ist ein Stoff gasförmig, bewegen sich die Teilchen in noch höherer Geschwindigkeit, die Anziehungskraft zwischen ihnen ist deutlich geringer. Stoffe können ihren Aggregatzustand ändern: So verdampft Wasser zum Beispiel, wenn man es zum Kochen bringt und gefriert, wenn man es abkühlt. Sein Gefrierpunkt liegt bei 0 Grad Celsius. Nicht nur ein flüssiger Stoff, sondern auch ein Gas kann gefrieren.
Trockeneis bleibt, wie der Name schon sagt, beim Schmilzen "trocken", da es direkt in Gas übergeht. Es handelt sich um Kohlenstoffdioxid, seine chemische Abkürzung lautet CO2. Trockeneis ist sehr viel kälter als normales Eis. Es hat eine Temperatur von minus 78 Grad Celsius und ist daher nicht ungefährlich. Es ist so kalt, dass man sich schwere Hautverletzungen holen kann, wenn man es mit bloßen Händen anfasst. Deshalb sollten nur Menschen mit Trockeneis umgehen, die sich damit auskennen und Schutzhandschuhe tragen.
Verflüssigt man Gase, werden sie noch viel kälter als Trockeneis - und zwar bis zu minus 200 Grad Celsius. Hält man dann zum Beispiel eine Banane in diese Flüssigkeit, gefrieren alle Wasseranteile in der Frucht, und sie wird um einiges härter als bei Raumtemperatur. Man könnte sie sogar als Hammer benutzen und mit ihr einen Nagel in ein Stück Holz schlagen. Allerdings sind Stoffe wie flüssiger Stickstoff sehr gefährlich, da sie so kalt sind, dass alles, was Wasser enthält, in ihnen gefriert.
Um Gase zu verflüssigen, muss man sie abkühlen. Erhitzt man flüssige Stoffe, sieden sie irgendwann. Das heißt, sie werden gasförmig. Sobald sie bis unter ihren Siedepunkt abgekühlt sind, werden sie wieder flüssig. Der Siedepunkt mancher Gase liegt weit unter minus 100 Grad Celsius. Man kann ihn erreichen, indem man das Gas unter sehr hohem Druck verflüssigt. Bereits flüssiges Gas muss man nicht mehr mit extrem niedrigen Temperaturen kühlen, um es flüssig zu halten.
Trockeneis: Gefrorenes Gas

Trockeneis findet in vielen Bereichen Anwendung. Es wird zum Beispiel in der Medizin verwendet, um Medikamente während des Transports kühl zu halten. Im Fernsehen oder in Diskotheken werden damit Spezialeffekte erzielt. Auch aus Filmen wie Harry Potter kennt man es, wenn der Zauberkessel wieder einmal überbrodelt. Auch das Obst im Supermarkt wird mithilfe des Trockeneises gekühlt. Vielleicht hast du schon mal den Nebel beobachtet, der aus den Rohren oberhalb der Obsttheke austritt.
Taucht man Trockeneis in einen Behälter, der mit Wasser gefüllt ist, reagieren die Stoffe sofort miteinander. Es entsteht Nebel, während das Wasser anfängt zu brodeln. Zur Nebelbildung kommt es, da das minus 78 Grad Celsius kalte Trockeneis die Luftfeuchtigkeit direkt über dem Behälter erstarren lässt. Das Trockeneis schmilzt in dem viel wärmeren Wasser und wird sofort gasförmig. Zum Brodeln kommt es, da Kohlenstoffdioxid leichter ist als Wasser und nach oben steigt. Gleichzeitig ist CO2 schwerer als Luft. Es sinkt langsam abwärts und vermischt sich mit der Luft.
Sicherheit geht vor

Wusstest du, dass manche Stoffe, die wir im normalen Alltag zum Backen benutzen oder einfach nur einatmen, unter gewissen Umständen explosive Reaktionen hervorrufen können? Oberstes Gebot bei Laborarbeiten ist es, die Sicherheitsmaßnahmen zu beachten. Es kann immer etwas schief gehen. Beim Experimentieren sind einige Regeln zu beachten, damit man sich und andere nicht in Gefahr bringt.
Bei chemischen Versuchen, die nicht immer ungefährlich sind, trägt man grundsätzlich eine Schutzbrille und einen Kittel. Im zweiten Teil unseres Artikels zeigen wir dir Versuche, die auch du zu Hause durchführen kannst. Wenn du unsere Experimente ausprobieren möchtest, solltest du nicht unbedingt die neuste Kleidung tragen, denn es kann immer mal etwas daneben gehen. Bei einigen der Versuche ist es von Vorteil, sie im Freien durchzuführen. Am besten machen deine Eltern bei deinen Experimenten gleich mit und lernen selbst noch etwas.

Hinweis zum Copyright: Die private Nutzung unserer Webseite und Texte ist kostenlos. Schulen und Lehrkräfte benötigen eine Lizenz. Weitere Informationen zur SCHUL-LIZENZ finden Sie hier.
Wenn dir ein Fehler im Artikel auffällt, schreib' uns eine E-Mail an redaktion@helles-koepfchen.de. Hat dir der Artikel gefallen? Unten kannst du eine Bewertung abgeben.











 Wie atmen ausgewachsene Frösche?
Wie atmen ausgewachsene Frösche?